ABN AMRO: Levering medische hulpmiddelen in gevaar door strengere Europese wetgeving
ArrayUit angst voor acute tekorten aan medische hulpmiddelen wordt de transitieperiode van nieuwe Europese wetgeving waarschijnlijk verlengd. Sommige medische hulpmiddelen zijn momenteel niet leverbaar omdat de certificering te lang duurt. Strengere eisen die op termijn veiligheid van patiënten moeten borgen, leiden ook tot stijgende prijzen van medische hulpmiddelen, afname van innovatie en verschraling van het aanbod.
Medische hulpmiddelen blijken niet altijd veilig te zijn. De afgelopen decennia hebben grote veiligheidsincidenten het debat over strengere wetgeving voor medische hulpmiddelen aangewakkerd. Schandalen bij onder andere borstimplantaten, heupimplantaten en bekkenbodemmatjes zorgden ervoor dat het International Consortium of Investigative Journalists (ICIJ) in 2018 de ‘Implant files’ heeft opgezet, een platform dat veiligheidsdata openbaar maakt op basis van grootschalig journalistiek onderzoek naar medische hulpmiddelen.
Daarnaast is als reactie op de schandalen nieuwe Europese wetgeving opgesteld, die in 2017 door het Europees Parlement is goedgekeurd. De zogenoemde Medical Device Regulation (MDR) bevat strengere kwaliteitseisen en maakt monitoring van producten op de Europese markt verplicht. Na een jaar uitstel is de wetgeving 26 mei 2021 van kracht geworden. Nieuwe producten moeten vanaf dat moment aan de nieuwe wetgeving voldoen en daarmee over een nieuw certificaat beschikken, voor bestaande producten is een transitieperiode van drie jaren ingelast die nu waarschijnlijk wordt verlengd.
Angst voor tekort door trage certificering
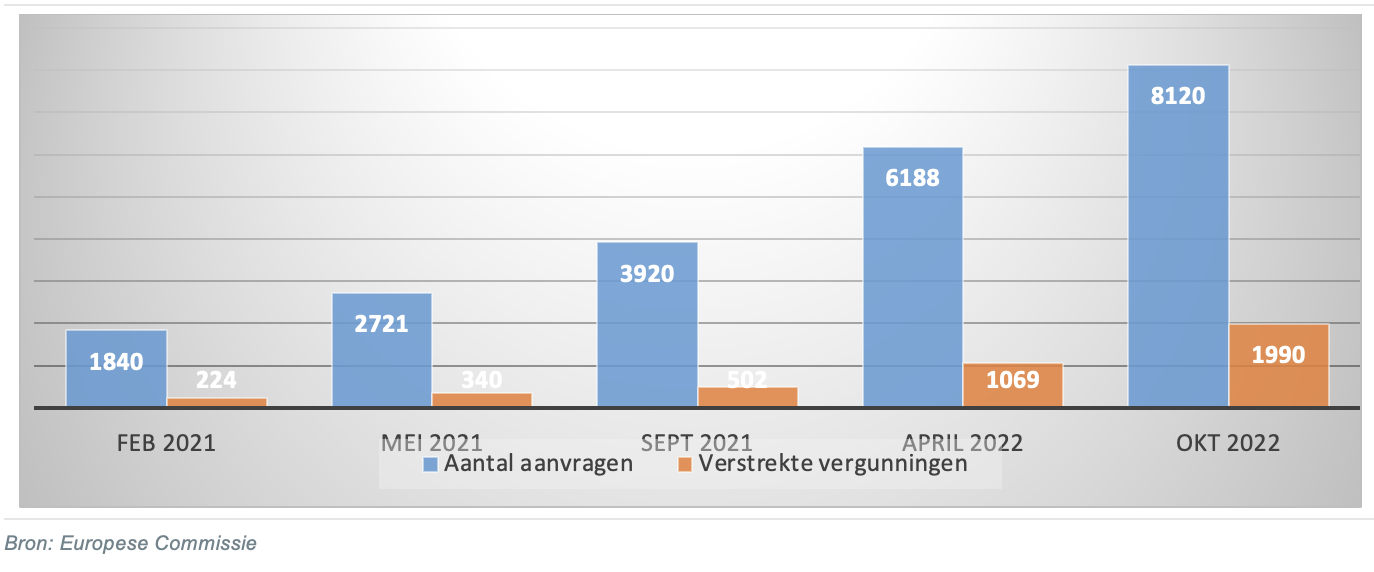
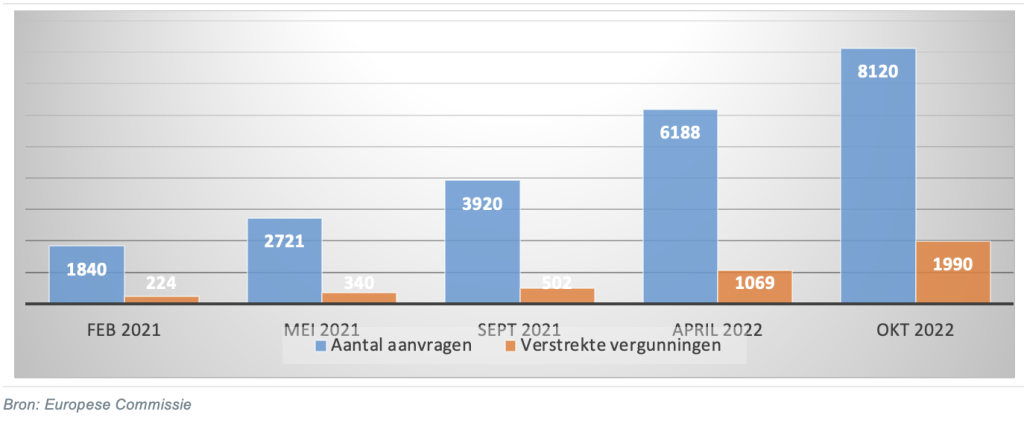
De certificering onder de nieuwe wetgeving verloopt traag. Sinds 2019 dienen producenten aanvragen bij certificeringsinstanties in om nieuwe en bestaande producten te laten keuren onder nieuwe wetgeving. Hoewel alle producten voor 26 mei 2024 gekeurd moeten zijn, kunnen alle aanvragen naar verwachting pas in 2027 verwerkt zijn door een tekort aan certificeringsinstanties en een langere doorlooptijd als gevolg van de strengere eisen. In april 2022 beschikte 15 procent van de in totaal 500.000 medische hulpmiddelen over een MDR-certificaat, blijkt uit een enquête van Medtech Europe.
Sommige producten mogen niet meer verkocht worden omdat het oude certificaat verlopen is. Zo is het certificaat van Synergie Care, producent van specialistische bedden voor de behandeling van zware wonden, op 1 september 2022 verlopen. “Terwijl we al vier jaren bezig zijn met de transitie naar de nieuwe wetgeving mogen we op dit moment onze producten niet leveren”, zegt Ger Bouwens, directeur van Synergie Care. “Het certificaat hadden we al een jaar geleden aangevraagd en eerder verwacht.” De capaciteit bij certificeringsinstanties is te gering. Daarnaast is uitstel van uitgifte vaak het resultaat van interpretatieverschillen van de normen in de nieuwe wetgeving, in plaats van mogelijke gebreken van producten. Producenten maken zich zorgen over hun voortbestaan omdat certificering lang uitblijft.
Certificering verloopt traag door strenge eisen
Certificaten uitgegeven onder de oude richtlijn verlopen zonder verlenging voor 26 mei 2024, waarna een product niet meer verkocht mag worden. De Europese Commissie vreest een tekort aan medische hulpmiddelen en pleit daarom voor het verlengen van deze transitieperiode. Als het Europees Parlement het voorstel tot verlenging goedkeurt, mogen producten uit de hoogste risicogroep tot december 2027 worden verkocht zonder een MDR-certificaat en die uit lagere risicogroepen tot december 2028.
Als het voorstel niet wordt goedgekeurd mogen producten zonder MDR-certificaat zoals gezegd vanaf medio 2024 niet meer verkocht worden. Hoewel een tekort aan kritieke medische hulpmiddelen voorkomen moet worden, is het risico van de verlenging dat medische hulpmiddelen op de markt blijven die mogelijk niet voldoen aan de strengere kwaliteitseisen. Daarnaast kan het verkopen van producten met verlopen certificaten leiden tot verwarring bij zorgaanbieders en groothandels, met name op afzetmarkten buiten Europa.
Complexe wetgeving vertraagt innovatie
De reacties op de marktconsultatie over het voorstel van de Europese Commissie laten een gemengd beeld zien. “De wetgeving is complex en de invoering vergt grote zorgvuldigheid. Daar is meer tijd voor nodig”, stelt René Drost, bestuurder van adviesbureau in zorgtechnologie NAMCO, die de reacties heeft geanalyseerd. “Het uiteindelijke doel is dat de wet een succes wordt en dat de continuïteit van goede zorgverlening wordt zeker gesteld.”
De complexiteit van de wet en onduidelijkheid over de duur van de overgangsperiode laten producenten en zorgaanbieders in onzekerheid. Bepaalde productielijnen worden gestaakt vanwege de nieuwe wetgeving. Sommige producenten zijn vooruitlopend op de invoering al gestopt met productie, zij zullen nu inkomsten mislopen. En zoals gezegd blijft het onduidelijk wanneer producenten een certificaat onder de nieuwe wetgeving kunnen bemachtigen.
In dit licht is het voor producenten lastig om plannen te maken en contracten af te sluiten met groothandels en zorgaanbieders. De lange wachttijden houden waarschijnlijk nog jaren aan. Innovatie in Europa vertraagt omdat nieuwe producten later op de markt komen. Uit de enquête van Medtech Europe onder producenten blijkt dat de certificering met 13 tot 18 maanden twee keer zo lang duurt als onder de oude richtlijn. De helft van de producenten wil daarom nieuwe producten eerder in Azië en de Verenigde Staten in plaats van in Europa op de markt brengen.
Medische hulpmiddelen duurder door strengere wetgeving
De nieuwe wetgeving vervangt de Medical Device Directive (MDD). Anders dan deze MDD-richtlijn is de MDR wel bindend voor alle lidstaten, waardoor geen regionale verschillen in implementatie ontstaan. Daarnaast bevat de wetgeving aanvullingen op de vorige richtlijn. Met deze aanvullingen wil de Europese Commissie de markt transparanter maken en de kwaliteitsstandaard van medische hulpmiddelen verhogen om patiënten en medici te beschermen.
Met name aan certificering zijn strengere eisen gesteld waardoor de invoering van de wetgeving is vertraagd. Certificeringsinstanties moeten namelijk zelf aan strengere eisen voldoen waardoor ze minder makkelijk een vergunning bemachtigen. Waar onder de oude richtlijn 54 certificeringsinstanties actief waren, zijn dat er onder de nieuwe wetgeving slechts 36. Naar verwachting loopt dit aantal op, maar dit zal in een laag tempo zijn, aangezien het ruim twee jaar duurt voordat een instantie na de eerste aanvraag een vergunning kan krijgen. Daarnaast moeten certificeringsinstanties meer gegevens opvragen en intensiever controleren bij de producenten. Hierdoor kunnen de nu actieve instanties minder aanvragen verwerken en moeten producenten langer op een certificaat wachten.
De strengere eisen zullen leiden tot hogere prijzen en een smaller productaanbod. De hoge kosten voor de certificering en monitoring worden immers waar mogelijk doorbelast aan groothandels en gebruikers van medische hulpmiddelen, waardoor de prijzen van medische hulpmiddelen stijgen. Bovendien worden bepaalde producten vanwege de hogere kosten en intensievere controle sowieso niet meer op de markt gebracht. De verwachting is dat de komende jaren een op de vijf producten verdwijnt. Met name ziekenhuizen vrezen straks andere hulpmiddelen aan te moeten schaffen waar ze niet direct mee uit de voeten kunnen. Ook worden ze bij een afname van het aantal aanbieders afhankelijker van één bepaalde producent.
Ook om andere redenen zal de MDR tot duurdere producten en een verschraling van het aanbod leiden. De definitie van medische hulpmiddelen is met de invoering van de MDR namelijk breder geworden waardoor meer producten onder de nieuwe wetgeving vallen. Dit geldt onder andere voor middelen om medische hulpmiddelen te reinigen en voor hulpmiddelen die gebruikt worden bij cosmetische ingrepen. Daarnaast verplicht de MDR producenten om gebruik en veiligheid van producten beter te monitoren. Producenten moeten een kwaliteitsmanagementsysteem opzetten en zelf klinische testen uitvoeren voor risicovolle producten. Voorheen mochten klinische resultaten ook op openbare onderzoeken gebaseerd zijn. Dit zal de kosten van ontwikkeling en productie verder opvoeren.
MDR heeft gevolgen voor de hele keten
Een ander punt is dat de MDR zich niet beperkt tot eisen aan producenten, maar tevens eisen stelt aan groothandels en distributeurs. Gecertificeerde producten moeten beschikken over een traceerbare code. Met behulp van deze code wordt de route van artikelen vastgelegd in systemen van groothandels en distributeurs. Transparantie over de herkomst en bestemming van medische hulpmiddelen helpt producenten om incidenten beter in kaart te brengen en te verhelpen. Momenteel wordt gewerkt aan het Europese systeem Eudamed waarin alle medische hulpmiddelen geregistreerd worden. Daarin kunnen groothandels ook direct zien of een product over de juiste certificaten beschikt.
En tot slot blijft ook de eindgebruiker niet buiten schot. Ze hebben straks minder keuze tussen verschillende varianten van medische hulpmiddelen door verschraling van het aanbod. Daarnaast kunnen gebruikers van medische hulpmiddelen worden aangemerkt als producent op het moment dat ze producten die bedoeld zijn voor eenmalig gebruik toch hergebruiken, of wanneer ze aanpassingen doen aan een product. Vanaf dat moment is de producent niet meer verantwoordelijk.
Met name kleine producenten hebben moeite met transitie naar MDR
De transitie gaat grote producenten beter af dan kleine producenten. Van de genoemde 15 procent van alle medische hulpmiddelen in 2022 over een MDR-certificaat beschikken, is slechts een klein deel afkomstig van het midden- en kleinbedrijf. Van hen beschikt slechts 6 procent over nieuwe certificaten. Voor kleine producenten is het een extra uitdaging om alle vereiste documentatie op te stellen. Ongeveer 15 tot 30 procent van het midden- en kleinbedrijf geeft aan nog geen toegang tot een certificeringsinstantie te hebben.
Producent van medische hulpmiddelen B. Braun keurt nieuwe producten al sinds 2019 onder de MDR. Inmiddels beschikken zij al over certificering voor 90 procent van hun 20.000 producten. “Bij grote producenten loopt het wel, maar kleine producenten stoppen ermee en worden soms overgenomen”, stelt Jos Majoor, senior productmanager bij B. Braun. “Zij hebben niet de mankracht en het geld om de MDR-certificering rond te krijgen.” Het opzetten van een kwaliteitsmanagementsysteem vergt namelijk veel expertise en kost veel uren.
B. Braun kijkt ook kritisch naar hun eigen productaanbod. Zo geeft Majoor aan dat waarschijnlijk rond de 10 procent van de producten af valt. Dit geldt niet voor “medische hulpmiddelen die veel gebruikt worden en producten waar de zorg niet zonder kan blijven bestaan. Van bepaalde producten zullen straks net iets minder niche types op de markt verkrijgbaar zijn”, waardoor zorgaanbieders zich volgens Majoor geen zorgen hoeven te maken om een te beperkt aanbod.
Bron: David Bolscher, Sectoranalist Industrie